GCP解读:建设临床试验的质量管理体系
质量是临床试验的核心,保证临床试验的真实、可靠与合规,是除受试者保护外的GCP执行的另一基本考量临床试验参与者众多,耗时漫长,其质量管理有赖于体系化建设,2020版GCP指出“申办者需建立起涵盖临床试验全流程的质量管理体系QMS,涉及试验设计、实施、记录、评估、结果报告和文件归档” (GCP13)。数据质量管理是临床试验项目管理的重要子项,已另写文详述
一、术语与定义
质量管理
指确定质量方针、目标和职责,并通过质量体系中的质量保证、质量控制和质量改进使其实现所有管理职能的全部活动
质量保证QA(系统)
一类有计划的、成体系的行动,其建立是为了保证/ensure临床试验的实施和数据的生成、记录和报告均遵守试验方案和相关法律法规,着重于预防错误的发生(GCP术语35)
质量控制QC(工具)
指在临床试验质量保证系统中,为确证/verify临床试验所有相关活动是否符合质量要求而实施的技术和活动,着重于发现和解决已存在的问题 (GCP术语36)
监查
指监督临床试验的进展,保证临床试验按照试验方案、标准操作规程和相关法律法规要求实施、记录和报告的行动(GCP术语13)
稽查
对整个临床试验质量体系(相关活动和文件)进行系统、独立的检查,以评估确定临床试验相关活动的实施、试验数据的记录、分析和报告是否符合试验方案、标准操作规程和相关法律法规的要求(GCP术语16)
二、质量管理策略
基于风险的质量管理体系
建立的实施质量管理体系需首先明确质量方针和目标,执行何种质量管理策略。2020年版GCP指出“申办者基于风险进行质量管理”(GCP31),“临床试验质量保证和质量控制的方法应当与临床试验内在风险和所采集信息重要性相符”(GCP30)。事实上,绝大多数研究并不要求绝对无差错数据(error-free),只需保证能得出与无差错数据相同的结论,或者说“只要求不存在不能接受的风险”。
基于风险的质量管理根据环节或数据的风险程度,针对性确定处理优先级和资源分配多少,保证项目可操作性的同时,又不降低试验质量和合规性要求。这有赖于对临床试验各环节的科学性认识,且这种认知是在质量管理体系的实施过程中不断改进和优化的。相关理念早被写入ICH Q8-Q10,并在药品生产领域得到积极应用
基本流程
① 风险识别
借助风险评估和分类工具RACT,识别影响受试者权益和安全、试验结果真实可靠合规的关键质量因素,进一步确定影响关键质量因素的风险因素② 风险评估
评估各风险因素的严重程度、监测难易、发生概率,确定关键风险指标KRI(Key Risk Indicators)③ 风险控制
组织SOP培训,源头上减少风险问题发生:
加强监查,及时发现处理风险问题;
设置不同风险的容忍度,KRI对应更低的错误接受率,并确定超出风险容忍度时的应对措施④ 持续改进
结合试验产生的新知识和经验,定期评估和改进风险控制措施应用-质量源于设计
常规的质量管理实践,往往只能发现临床试验中已事实产生的问题,并不能从根本上提高试验质量。好的临床试验是做出来的,而不是查出来的,临床试验质量应当基于良好的设计和实施
“质量源于设计QbD”将风险识别前置到“设计”阶段,主动驱动临床试验的质量。常见的“质量源于设计”实例,如在试验设计早期,考虑统计分析需要,提早控制偏倚。ICH E8(R1)征求草案中便新增了“临床试验的质量设计”一章,并给出确定关键质量因素的思路与实例
应用-中心化监查
得益于电子采集系统EDC、云存储平台等电子化技术在临床试验的普及,使得研究团队能够获得数据的实时整体视图,并通过统计学分析及时识别风险问题,进一步使得中心化监查得以落地
“中心化监查”是指及时的对正在实施的临床试验进行远程评估,汇总分析不同临床试验机构采集的数据,观察机构内/机构间的数据范围和一致性,有助于选择监查现场和监查程序(GCP49.7,语言有删减)
此类“有因”监查,基于临床试验“实施/记录/报告”环节的风险识别(RBM)。通过分析判断某一试验基地的入组比例、AE/SAE、PD数目,query数目相比其他中心是否更多,针对性倾斜资源,向高风险研究中心释放更多监查力量。相比传统现场访视的访视周期局限(访视可能发生在问题发生数周后),中心化监查能帮助快速识别问题,减少偏差给试验带来的影响
应用-针对性SDV
MediData数据显示,源数据核查SDV耗费的临床预算超过15%,是仅次于机构费用的临床试验第二大支出项,但100%的SDV仅改变了不到3%的源数据(参考资料6)。“检查时采用统计学抽样调查的方法核对数据”(GCP49.8)显得合理且必要
针对性SDV基于风险原则,确定关键/非关键CRF字段的不同审查要求,在高风险影响活动中分配更多监查资源。《临床试验数据管理工作技术指南》给出的参考的核查计划是:关键指标100%复核,非关键指标抽样10%复核(总病例大于100),或抽样总病例数的平方根(总病例小于100)。数值变量不超过 0.2%,文本变量不超过 0.5%,错误率超过此标准,将进行100%核对
三、质量管理体系文件
标准操作规程SOP
质量管理体系的实施和运行依赖于质量管理体系文件,一般由四部分组成:质量手册、 标准操作程规程、操作手册、质量记录。重点介绍标准操作规程SOP,其是指为保证某项特定操作的一致性,而制定的详细的书面要求(GCP术语23)
2020年版GCP指出“申办者需制定、实施和及时更新有关临床试验质量保证和质量控制系统的标准操作规程”(GCP32.1)。事实上,GCP要求所有临床研究参与人员/角色均需按照SOP开展工作,包括伦理委员会、研究者、监查员、数据管理员,乃至电子数据管理系统
执行SOP的好处
通过统一标准,SOP能最大限度保证不同人员不同时间的操作均一性,从而减少各种主客观因素带来的试验偏倚。SOP是临床试验的质量标杆,研究团队基于SOP进行人员培训,也同样基于SOP监查/稽查/检查各方的依从性(compliance)
制定SOP的考量
制度化和标准化良好的公司/单位应当建立起规范的SOP制定流程,明确SOP新建-审查-发布-修订与版本控制的具体要求。高质量的SOP必须首先遵守GCP要求,同时简洁明了、可操作性强,能经得起实际工作的时间检验
四、人员、分工与培训
- 质量管理体系依托组织机构来协调和运行,必须建立一个与质量管理体系相适应的组织结构明确相关人员的责任和权限
- 研究者/CRO必须事先进行基于各自分工和职责的良好培训。提供的培训方式包括但不限于研究****中心启动会议(SIV meeting)、组织GCP课程等
五、质量改进
质量管理是动态的发展过程,质量体系的持续改善依赖于不断深化新的科学认识。一如PDCA循环所展示的,只有将基于“检查”的“修正”纳入“计划”环节,质量管理体系的更新迭代才能最终闭环
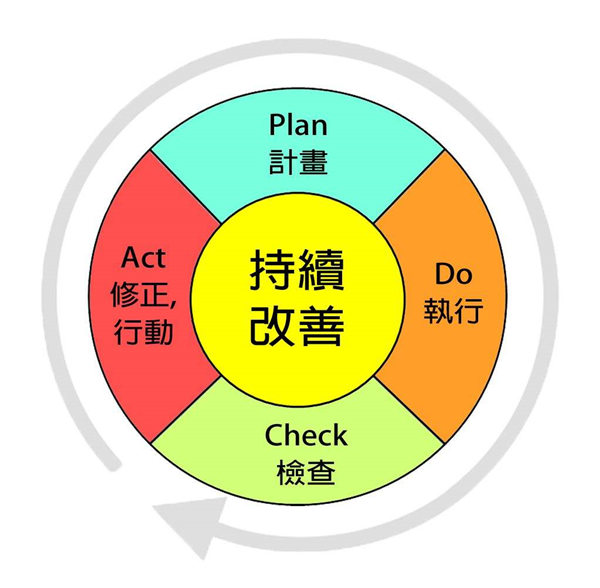
在临床试验的具体实践中,研究人员需分析错误产生的原因(RCA分析),并提出纠正预防措施(CAPA)防止同类错误再次发生;问题严重的还需进行SOP乃至试验方案等的修改。这一过程并不一定由QA稽查完成,也可以通过监查员的RMV,或是数据管理员的数据清理。质量改进的思想应当深植于每一个质量体系参与人员
参考资料:
[1] ICH-E8:临床研究的一般考虑(草案)
[2] 药物临床试验 监查稽查·广东共识(2020年版)
[3] 药物临床试验 质量管理·广东共识 (2020年版)
[4] 药物临床试验质量管理规范(2020年版)
[5] ICH-E6(R1):药物临床试验管理规范指导原则
[6]成功实施RBM的实际考虑-medidata白皮书
[7] 药物临床试验 质量管理·广东共识
[8] 药物临床试验数据管理工作技术指南
[9] GB/T 19001-2016质量管理体系要求
